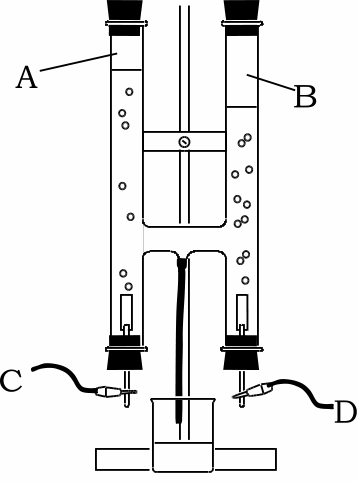
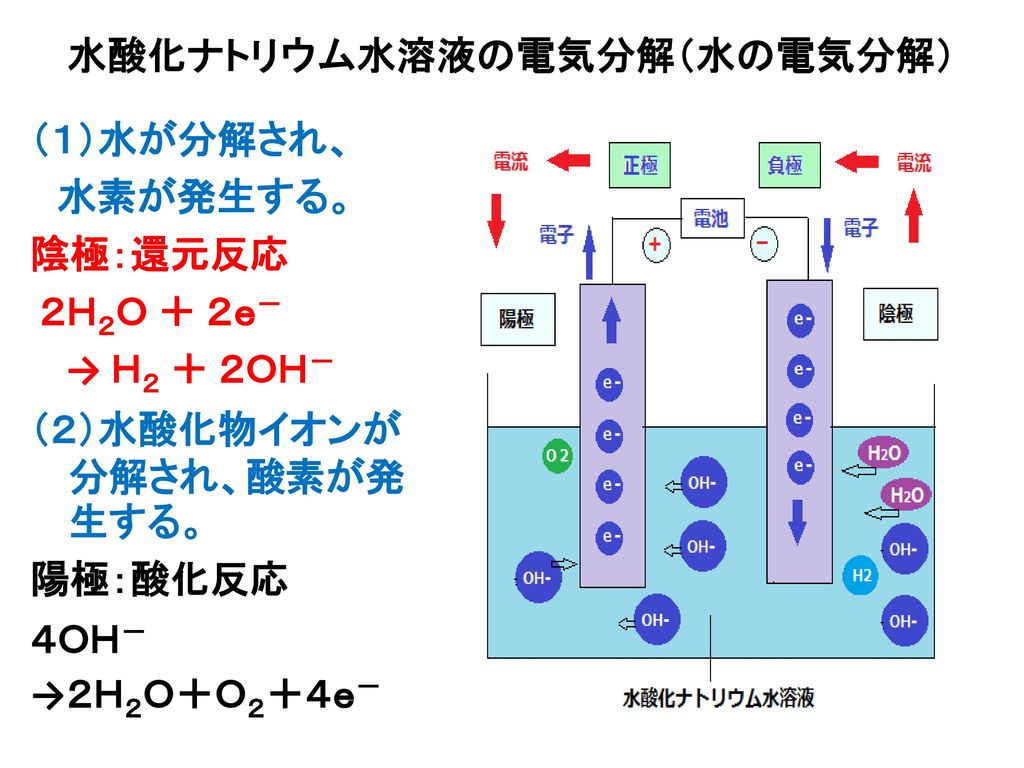
⑥ 陽極と陰極でそれぞれに発生する気体の体積比をかきなさい。 陽極 : 陰極 ⑦ 水の電気分解での変化を式で表す。下のア、イに適する物質を書きなさい。 水→ ( ア ) + ( イ ) = no3 点 水酸化ナトリウム を加えた水 電源装置 - 陽極 陰極実験装置概略図を図31 に示す。電源供給装置から電気分解セル(水電解槽)に直流電 流を供給した。電源供給装置は北斗電工㈱のha305(図32, 表31 参照)を用いた。供給 した電圧値、電流値は電源供給装置の電位記録端子、電流記録端子と江藤電気㈱製キャ 水の電気分解の分解の中学生向け解説ページ です。 「水の電気分解」 は中学2年生の化学で学習します。 ①水の電気分解の実験動画 ②水の電気分解で何ができるのか ③水の電気分解の化学反応式 ④水は熱分解ができるか(おまけ) を学習したい人は
Http Www Matsudo Ed Jp Mtd 5 J Index Cfm 7 2248 C Html 2248 0508 Pdf
水の電気分解 体積比
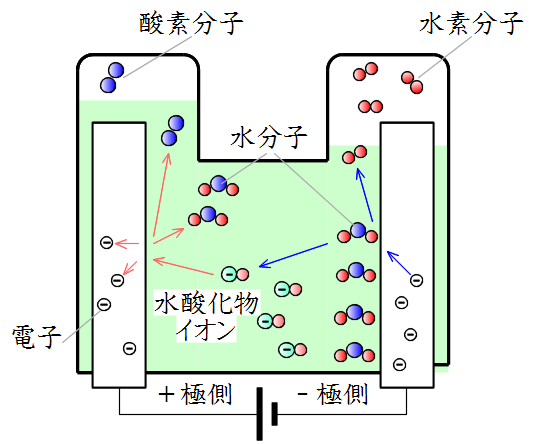
水の電気分解 体積比-くの体積の気体が発生する。 水酸化ナトリウム水溶液による水の電気分解では次のよ うな変化が起こっている。 陰極では,イオン化傾向の大きいナトリウムイオンは還 元されず,水分子が還元されて水素を発生する。 + -→ ↑+ -水の電気分解の本質である,陰極と陽極に,それぞれ水素と酸素が2:1の体積比で発生すると いう視点があまりないことがわかる。 水の電気分解の実験条件に関する再提案 111 2mol/L て生成



簡易電解装置 どの学校にもある ホフマンのh字管型電解 装置は 下端の電極のついたゴム栓が 水酸化ナトリウム溶液を使ったときにはずれやすく 思わぬ事故が起こることがあるが 電解装置としては やはりよくできている しかし 高価なので
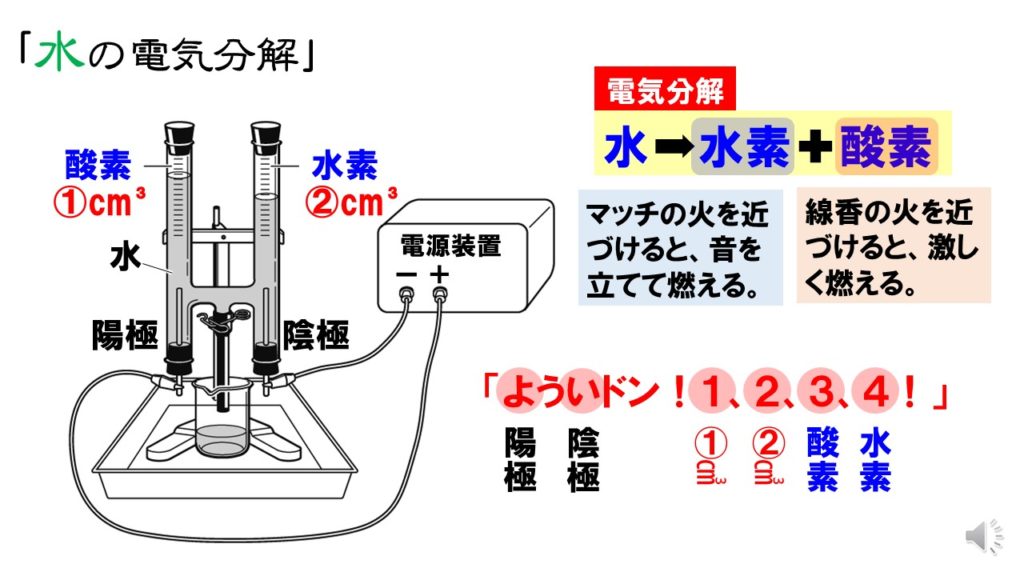
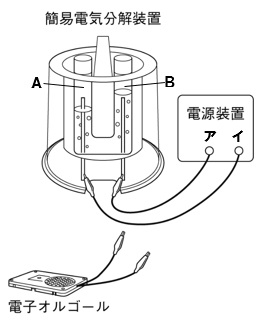
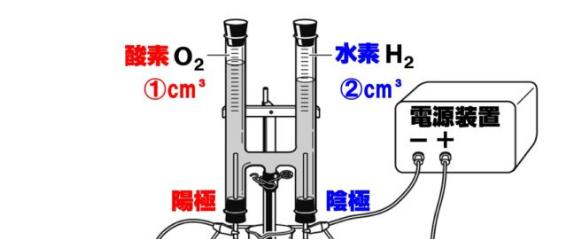
水の電気分解で、水に電流を流した時水素と酸素が21で発生すると授業でならったのです Clear 理科 中学生 11ヶ月前 あの🕊³ 水の電気分解で、水に電流を流した時水素と酸素が21で発生すると授業でならったのですが、 必ずしもぴったり21にならない 水の電気分解をおこなうとき、純粋な水は電流を通しにくいため、 などを溶かしてから電流を通す。 水の電気分解で発生する気体の体積比は、-極側と+極側でほぼ、 2:1 となり、-極側に 水素 、+極側に 酸素 が発生する。水の電気分解では、陰極側に④( 水 素 )が発生し、陽極側に⑤( 酸 素 )が発生する。 水の電気分解 右の図のような装置で、水の電気分解を行ったところ、 陰極側からは水素が、陽極側からは気体Aが発
発生した水素の体積は酸素の2倍である。水は水素と酸素に分解できる。 ・水の電気分解 水 → 水素 + 酸素 ・発生気体の体積比 水素:酸素=2:1 塩化銅水溶液を電気分解すると、極には塩素が発生し、極には銅が付着する。塩化銅は塩素と銅に分解 水を電気分解する化学反応式 さて、本題に戻りましょう。水を電気分解すると、酸素と水素に分解することができますね。 水→水素+酸素 2h₂o→2h₂+o₂ 電気分解により発生する気体の体積比 まず、発生する気体の体積比について考えてみましょう。アンモニア水の電気分解 (中学生に電気分解を教えた結果)哲猫 11 年10 月 日 中学2年生に電気分解を教えた。電池というものは、電子を押しだし(負極)電子を吸い上げる(正極) ポンプであると説明すると、生徒達は概ね理解できるようである。
中学2年理科。化学変化の中の分解「水の電気分解」について学習します。 レベル★☆☆☆ 重要度★★☆☆ ポイント:発生する気体と体積の覚え方、実験の手順水の電気分解水に電流を流すと、陽極から酸素が、陰極から水素が発生します。水→水素+酸水の電気分解と燃料電池 燃料電池は水の電気分解の逆反応である。電気分解については中学の理科や 高校の化学の時間に習ったことがあるだろう。図73 のように白金を電極とし、 希硫酸を電解質とする回路を組み、電流を流してみる。電極上でそれぞれ次の例題5) 0100mol/L の CuCl 2 水溶液1 L を白金電極板を用いて1A の電流で965 秒間電気分解した。 このとき、陽極板で発生する気体の標準状態の体積と陰極板に生じる固体の質量、および電気分解後の CuCl 2 水溶液の濃度を求めよ。 ただし、電気分解の前後で溶液の体積は変化しないものとする。




家庭でトライ 身近なものを使った水の電気分解 日本化学会 化学だいすきクラブ
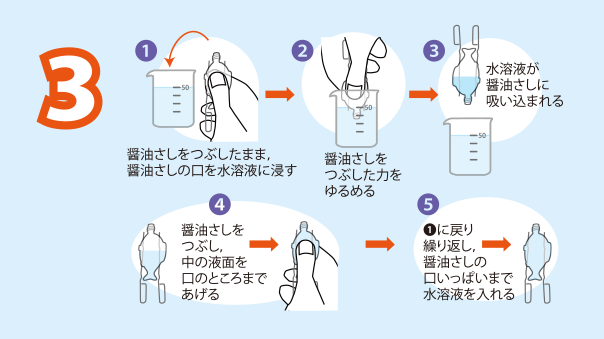



君も化学者 簡単にできる水の電気分解 日本化学会 化学だいすきクラブ
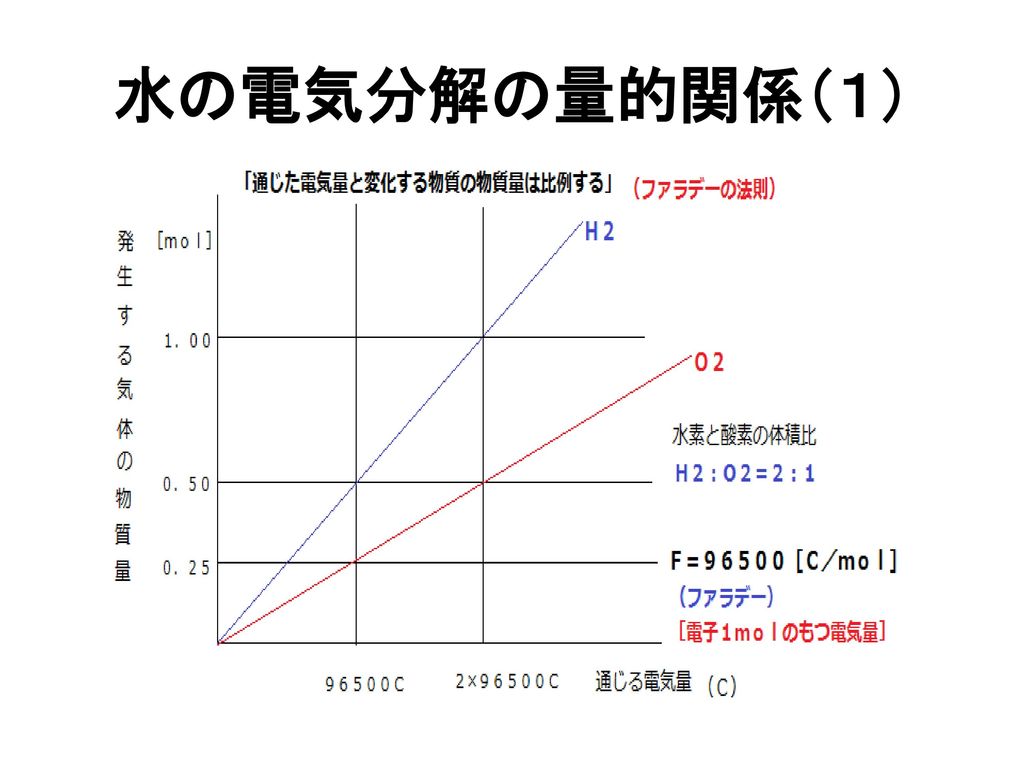
水の臨界点は圧力264 mpa、温度 °c ( k) である。水は臨界点まで蒸気圧曲線に従い、ある温度である圧力以上をかけると液体の状態を保つ。この状態の水(下限は大気圧、100 °c )を亜臨界水という。水の電気分解で発生した,体積比2:1 の水素と酸素の混合気体(爆鳴気)に点火する と,爆発的な反応が起こる。ポリスポイドを利用したNingHuaiZhou(周,00)によ る実験方法を紹介する。 1)材料 ・ポリスポイド(前出) 1本・ 水素と酸素の体積比は2:1 である。 本時 ・ 分子原子 ・ 化学変化のモデル化 ・ 物質は分子の集まりであり、その分 子は原子からできていること。 ・ 分子モデルを使って水の電気分解を 説明するこ




スタディピア 化学変化 分解と化合



Http Www Shotoku Ac Jp Data Facilities Library Publication Kyoiku54 6 Pdf
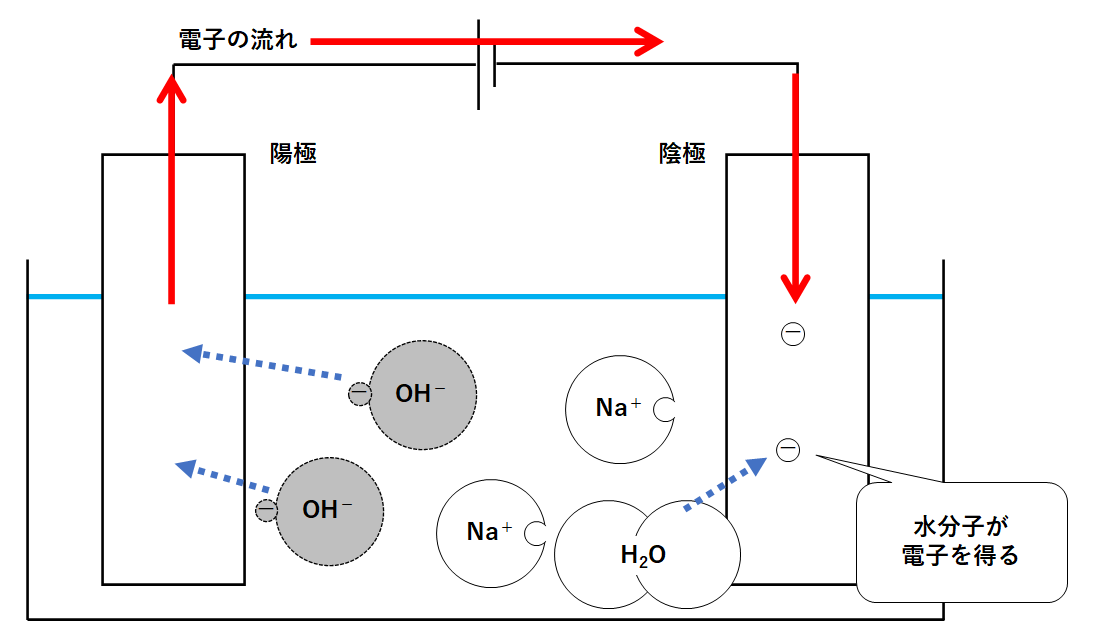
電気分解 5 30分 cpt3l1z1j301 要点 要点を読んで重要なポイントを確認しましょう。 電気分解 1電解質水溶液の電気分解 ・電解質の水溶液に直流電流を流して2種類の異なる物質に分解することを,電気分解とい います。中に残っている水溶液が出てくることがあります 実験の解説 水に電気を流すと,水が電気分解されて,水素と酸素が生成します。化学反応式であらわすと, 2h 2 o → h 2 +o 2 となります。生成した水素は,燃焼する気体です。 水分子が過不足なく電気分解されるとすれば、水分子が、水素原子:酸素原子の比率 2:1 であることはすぐわかります。 (但し、これだけでは、H4O2でも、H6O3でも矛盾しない。) な



中3理科 塩酸の電気分解のポイント Examee



3
化学 中三です。水の電気分解について 水の電気分解で、酸素と水素が1:2の割合で出てきて、酸素の原子と水素の原子では大きさが違うのに、なぜ体積の比も1:2になるのでしょうか。大きさが違うのであれば 質問No2 電気分解 check11 電気分解 電解質の水溶液などに外部から電気エネルギーを与えて,強制 的に酸化還元反応を起こさせること。電解ともいう。 暗記 陰極() 外部電源の負極につないだ電極。 電子が流れ込み,還元反応が起こる。 陽極()気体の体積比は反応式の係数の比に一致します。 水の電気分解の化学反応式は h2o→h2o2と書いてから係数をあわせることにより 2h2o→2h2o2と表せます。書いてませんがo2の前には1が隠れているので、h2とo2の係数の比は21ですね。 よって体積比は21になります。




中3化学 水の電気分解 中学理科 ポイントまとめと整理



簡易電解装置 どの学校にもある ホフマンのh字管型電解 装置は 下端の電極のついたゴム栓が 水酸化ナトリウム溶液を使ったときにはずれやすく 思わぬ事故が起こることがあるが 電解装置としては やはりよくできている しかし 高価なので
水を電気分解すると何故12の体積比に分解されるのか 水を電気 正体は、総括すれば、 2 h2o → 2 h2 o ;簡易型電気分解装置の製作と水素の燃焼実験の教材化 肆矢 浩一 Koichi YOTSUYA 1.はじめに 酸化還元の単元では,電気分解の実験が定番となっている。電気分解をスモールスケールで 行うと,1つの電解液について5~ 0分間で終了させることができる。水の電気分解とは?水の電気分解の実験と反応式 陽極・陰極での反応式 電気分解の仕組みの詳細はこちらで解説していますが、簡単に解説しますと 電気分解とは物質に対して電気的なエネルギーを加えることで分解を起こすことといえます 。




中学理科 水の電気分解の確認問題 Irohabook




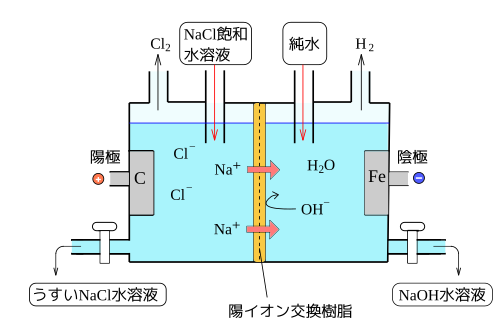
高校化学 Naoh水溶液の電気分解 陽極 映像授業のtry It トライイット
ホフマ ン型電気分解装置を用い て,水を電気分解し水素 と酸素が2;1の体積比で発生する様子から,発生する気 体の体積 (物質量〉と電気量との間に比例関係が成り立つ ことを示すには有効である1)。しかし,気体の状態方程式水の電気分解で、水素と酸素が生じる。 発生する水素と酸素の体積比は2:1。 を、ゴロ合わせで覚えていきましょう。 ちょっと、可哀想なゴロ合わせですがご容赦ください。 1 匹の プー さん 、 2 つの マ スイ で電気分解 は? ってなりますね。 解説し つまり、水の電気分解をすると"水素"と"酸素"が発生するのです。 これを化学反応式でまとめると 水 → 水素 + 酸素 2H 2 O → 2 H 2 + O 2 となります。 ここで、化学反応式の係数に注目してください。 係数とは、化学式の前についている数字の




水の電気分解をして2つの気体を調べよう 実験動画 理科の授業をふりかえる
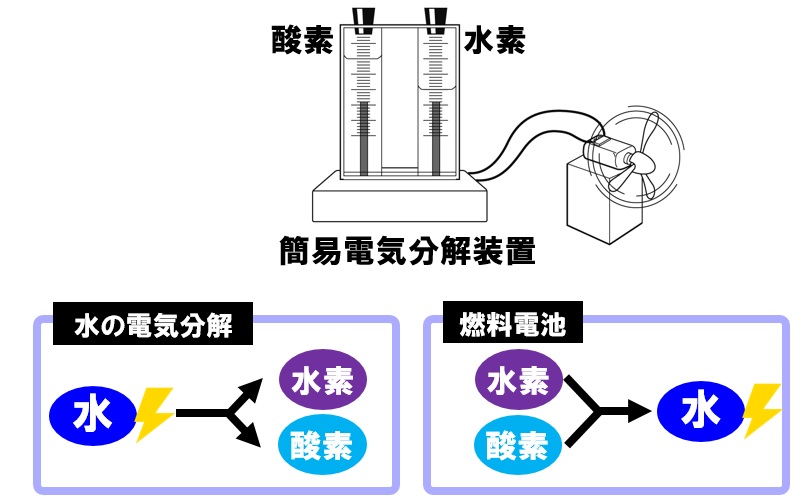



中3理科 燃料電池のポイント Examee
水の電気分解で発生する気体の体積比を調べる 超小型電解装 置の組み立て : 1) 電解支持板の二つの穴にツベルクリン用プラスチック注射器のシリンダーを下から通す。 水の電気分解装置 今まで出題されなかった理由 陽極と陰極に発生した気体 陽極と陰極での化学反応式 気体の体積を図から求める 酸素と水素の体積比 酸素原子と水素原子の質量比 ゆとり教育の前の入試問題には当たり前のように出ていた水の電気分解による水素と酸素の体積比や質量比。水を電気分解すると,水→水素+酸素の 反応がおこる。 発生する気体水素と酸素( )の体積比は, 水素:酸素=2:1 になる。上の暗記法 で,「陰極(-)に水素,陽極(+)に酸素が 発生し,その体積比は,水素:酸素 =2:1」ということを丸暗記しておく。




2の 2 が分かりません Clear




2 の解説をよろしくお願いします この問題の意味もよくわかりません Clear
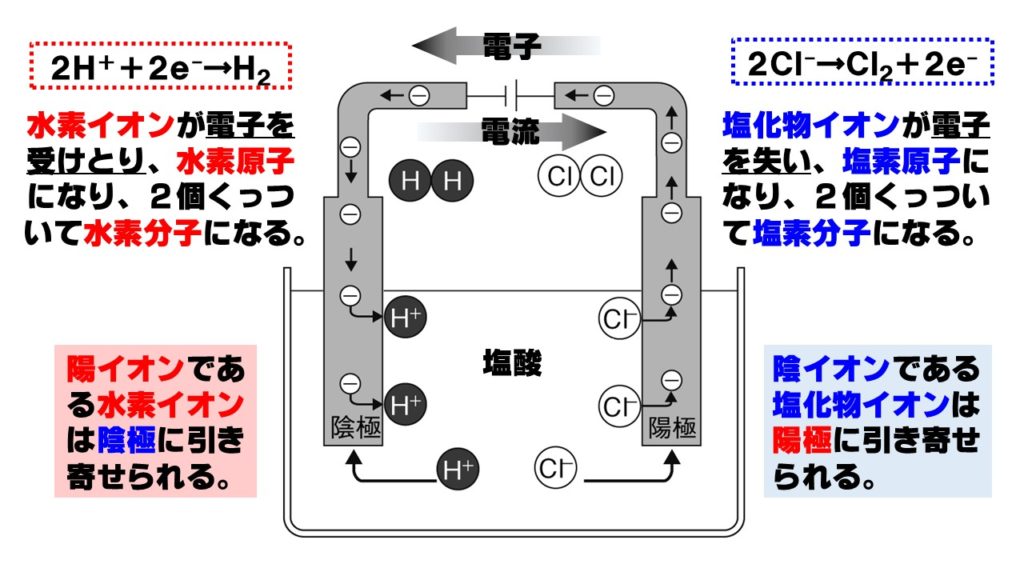
塩酸の電気分解 塩酸に電極を差し込み電流を流すと、塩酸が電気分解され、 陰極 から 水素 H₂ 、 陽極 から 塩素 Cl₂ が発生します。 これは、 塩酸中の陽イオンである水素イオン H⁺ が陰極に、陰イオンである塩化物イオン Cl⁻ が陽極に引き寄せられる ためです。 陰極から発生する水素と水を電気分解すると,次のように分解されることがわかりました。 水水素酸素 →+ 2HO 2H O222 発生する水素と酸素の体積比は,水素:酸素= です。2:1 ※ に発生する水素は燃えるので, を確認し陰極 マッチの火を近づけて,気体が燃えること ます。 LINE Pocket 水の電気分解反応は中学校で習う分解反応のひとつです。 化学式で書くと以下の通り。 2H 2 O → 2H 2 O 2 化学式で書くととても簡単ですが、意外にもこの反応が凄いんです。 何が凄いかというと、この反応を熱エネルギーだけで(加熱するだけ



Http Www Shotoku Ac Jp Data Facilities Library Publication Kyoiku54 6 Pdf
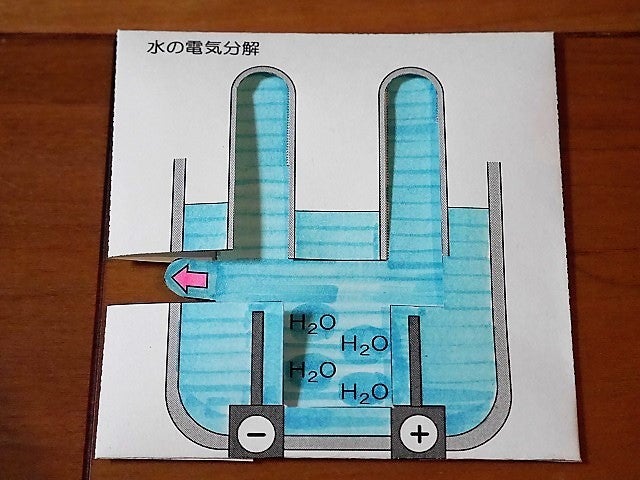



水の電気分解がノートで再現できる 理科の紙技 ペーパークラフトを授業に
水の電気分解では陰極には水素、陽極には酸素が発生する。 水の電気分解では陰極には水素、陽極には酸素が発生する。 ここでは、発生する気体が分かっているということが前提になっている。 電極Aと電極Bに発生した気体の体積比 学校のテストでは、発生する気体は何か?水を電気分解したときの軽水素hの反応速度定数 と 重水素dの反応速度定数 の比 ,およびトリチウム tの反応速度定数 との比 をその同位体の分離係数 および と呼び,この値を用いて電解前のトリチウム濃 度を求めることができる8. (2) :濃縮前の試料



化学変化と実験3



中2理科 水の電気分解 覚え方や実験の手順 Pikuu



水の電解



Http Www Matsudo Ed Jp Mtd 5 J Index Cfm 7 2248 C Html 2248 0508 Pdf




中2化学 分解 中学理科 ポイントまとめと整理



中2化学 水の電気分解 Hiromaru Note




この問題の 2 を教えてください お願いします Clear



3



水の電解



中3理科 燃料電池の定期テスト対策問題 Examee



Science 化学変化 水の電気分解のしくみ 働きアリ




2 の解説をよろしくお願いします この問題の意味もよくわかりません Clear



高等学校化学i 電池と電気分解 Wikibooks




中2理科 水の電気分解の要点まとめノート 中学生勉強サイトあかね先生




中2理科 水の電気分解 覚え方や実験の手順 Pikuu



中2理科 水の電気分解の要点まとめノート 中学生勉強サイトあかね先生




電気分解とは 電気分解を理解して定期テスト10点アップ 高校生向け受験応援メディア 受験のミカタ



Http Www Shotoku Ac Jp Data Facilities Library Publication Kyoiku54 6 Pdf



Http Www Shotoku Ac Jp Data Facilities Library Publication Kyoiku54 6 Pdf



中3化学 水の電気分解 中学理科 ポイントまとめと整理



中2化学 分解 中学理科 ポイントまとめと整理



Http Www Chemistry Or Jp Chemclub Backissues Nl6 Nl6p6 7 Pdf



Www City Asahikawa Hokkaido Jp Kurashi 218 251 257 D D Fil 12rika03 Pdf
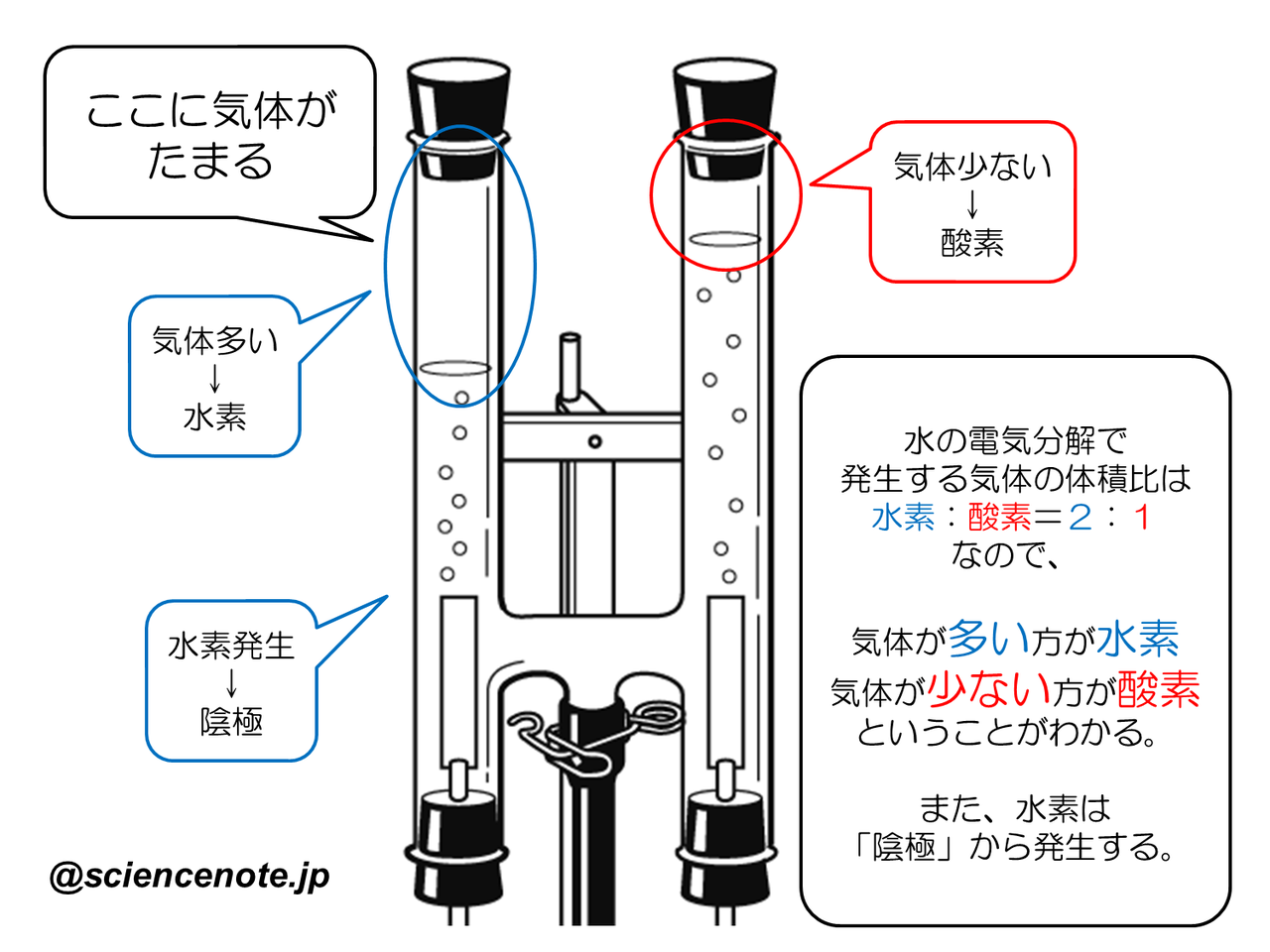



中2化学 水の電気分解 Hiromaru Note




ケニス株式会社 理科なび 教材の紹介
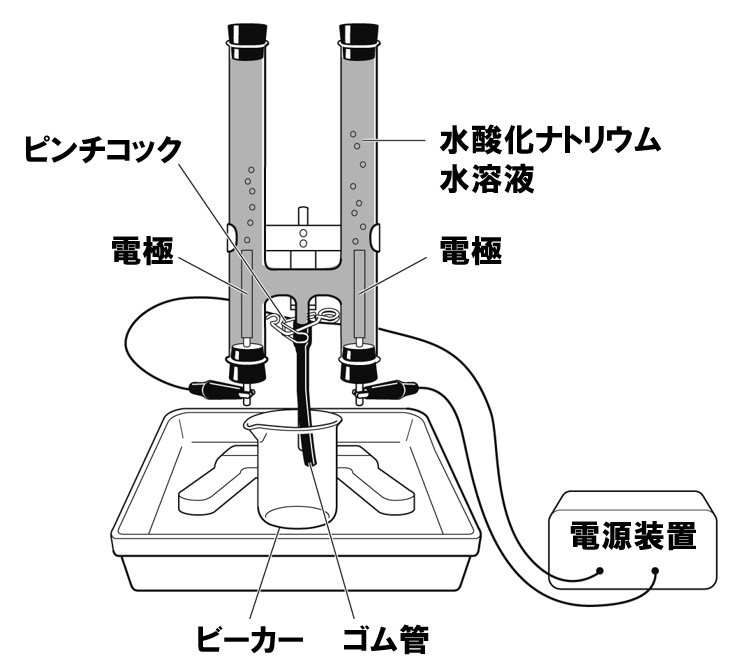



中2理科問題 水の電気分解 Examee
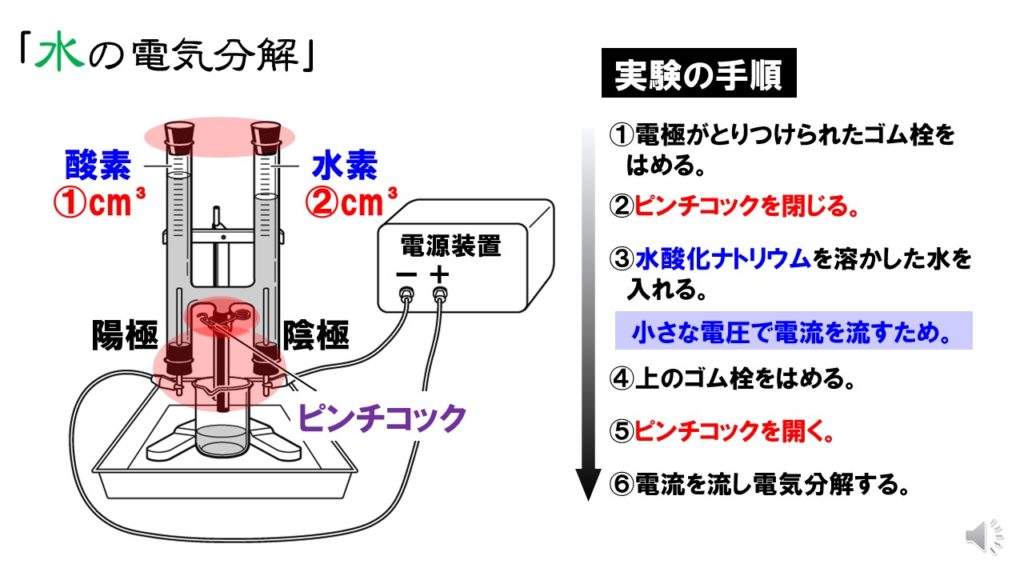



中2理科 水の電気分解 覚え方や実験の手順 Pikuu




理科3年 化学 イオン 電池 酸アルカリ エネルギー イオン 要点 原子 イオン 原子核は の電気を帯びた陽子と電気を帯びていない中性子から成り立っている 原子核の周りを の電気を帯びた電子が飛び回っている 陽子と電子の数は同じである



化学の水の電気分解で体積比が水素 酸素 2 1になるのはなぜですか ま Yahoo 知恵袋



水素と酸素の体積比について質問です 写真の表から 体積比が2 1だとい Yahoo 知恵袋




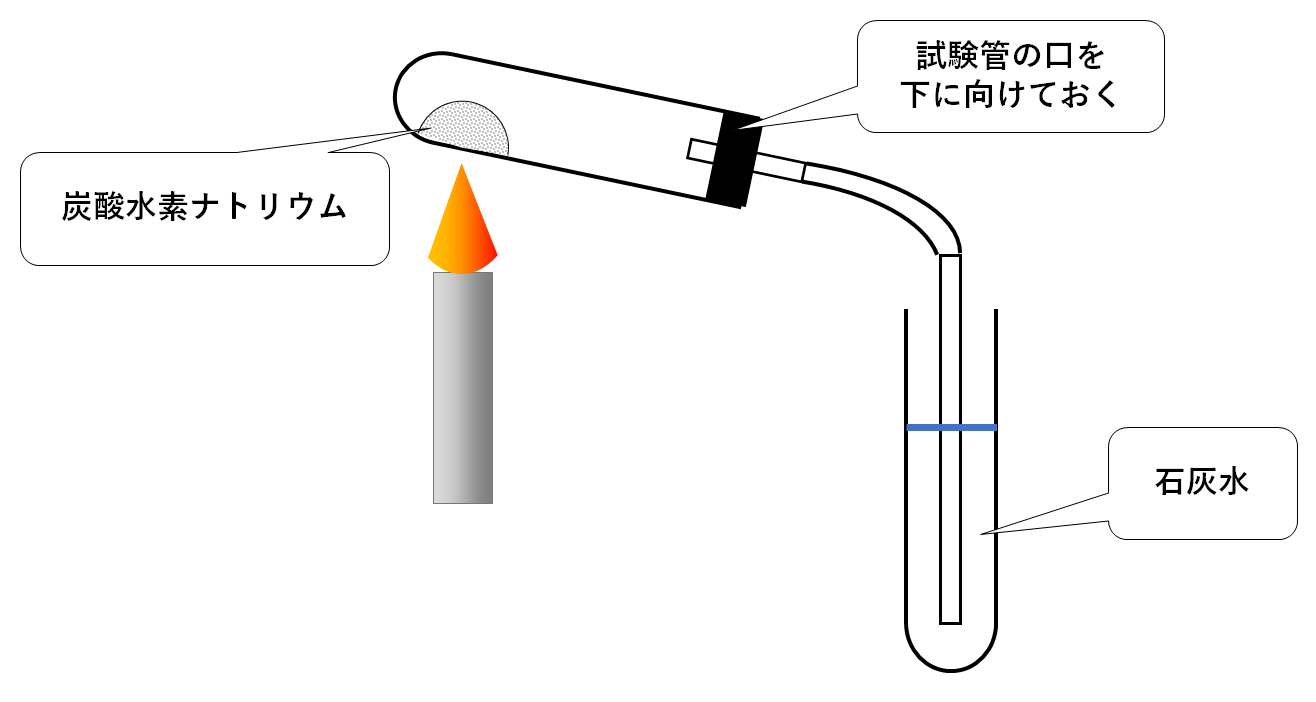
物質の成り立ち 熱分解 電気分解 Ict教材eboard イーボード



マイクロスケール水の電気分解




中2 中2理科 水の電気分解 中学生 理科のノート Clear




電気分解の仕組みと電気分解による様々な物質の化学反応式



Http Www Shotoku Ac Jp Data Facilities Library Publication Kyoiku54 6 Pdf



わくわくときめきマイクロ実験教室 仙台市科学館 Sendai City Science Museum




高速電気分解装置 日常から正方形に切り抜く
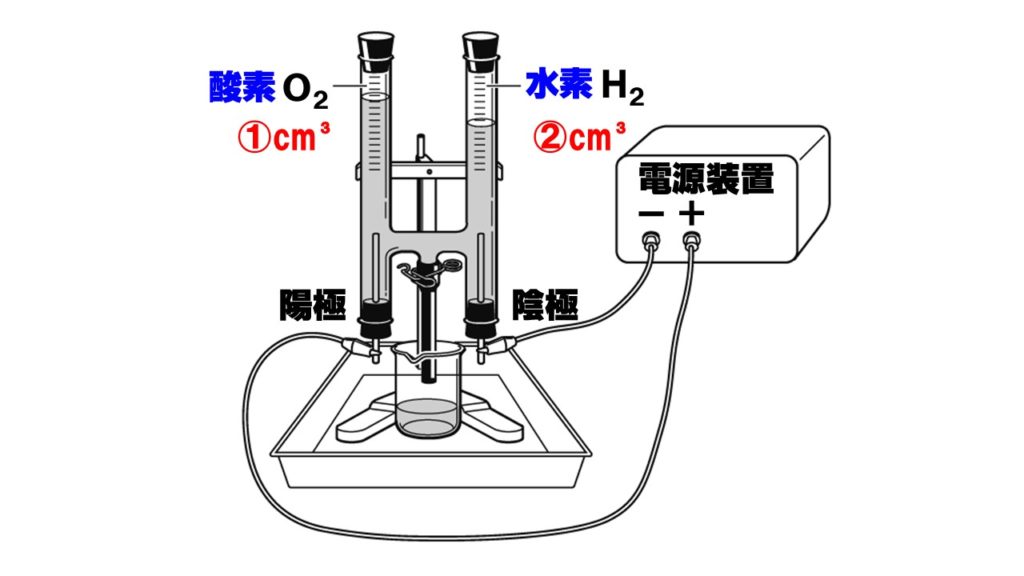



中3理科 水の電気分解をイオンで考える Examee
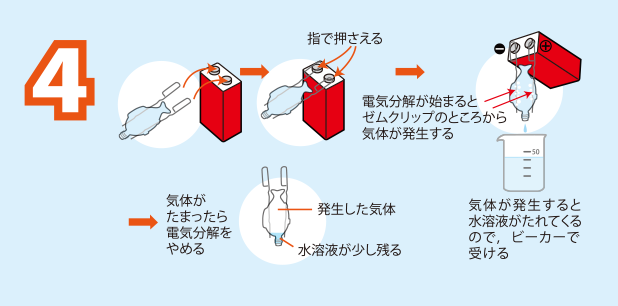



君も化学者 簡単にできる水の電気分解 日本化学会 化学だいすきクラブ



1 研究に取り組んだ観察 実験 4 化学変化と原子 分子 第1分野下 物質どうしは結びつくか 実験 水素と酸素の化合 2 観察 実験のねらい 大単元 化学変化と原子 分子 においては 生徒は分解や化合といった基本的な化学変化を目では見え




中学2年の理科 動画 水に電流を流すの問題 電気分解 19ch
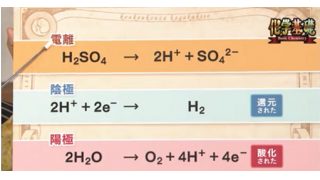



水と化学 水の電気分解 メタ坊のブロマガ ブロマガ



塩化銅 cucl2水溶液の電気分解 1 陰極で銅が析出 陰極 還元反応 cu2 2e cu 2 陽極で塩素が発生 陽極 酸化反応 2cl cl2 2e Ppt Download
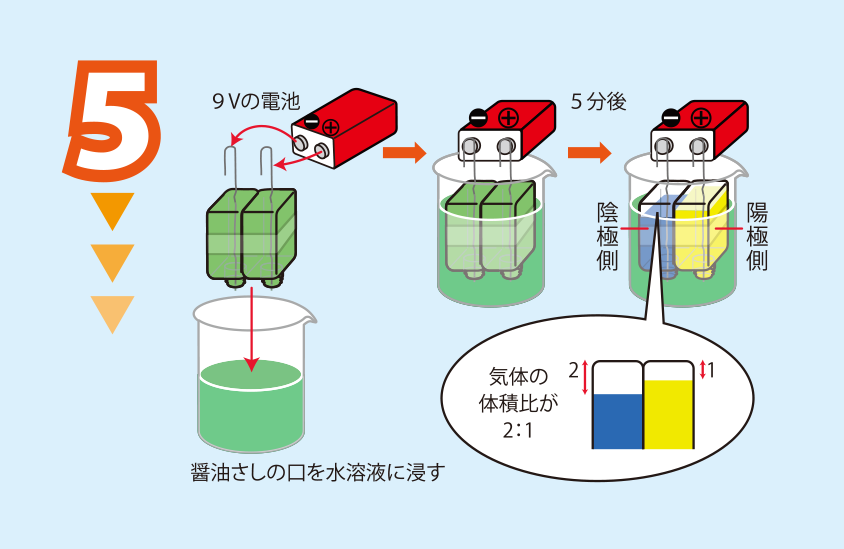



君も化学者 水を電気分解してみよう 日本化学会 化学だいすきクラブ




この場合陰極側に線香 陽極側にマッチを近づけたらどうなるんですか Clear



Soar Ir Repo Nii Ac Jp Record Files Vol 10 3 2 Pdf



Www Chuo Tky Ed Jp Ginza Jh Resources Content 0515 Pdf




中2 理科 化学 水の電気分解 14分 Youtube



Www Gakusho Com Kihon Ki Asset Pdf Pdf Rika Shimen Chu Pdf




中2 理科 実験問題 水の電気分解 1学期期末テスト 暗記用 赤城 ᐡᐤᐡ




中2理科 水の電気分解 映像授業のtry It トライイット




水の電気分解の解説 中学生向け




君も化学者 水を電気分解してみよう 日本化学会 化学だいすきクラブ



理科の授業 水の電気分解



塩化銅 cucl2水溶液の電気分解 1 陰極で銅が析出 陰極 還元反応 cu2 2e cu 2 陽極で塩素が発生 陽極 酸化反応 2cl cl2 2e Ppt Download



1 研究に取り組んだ観察 実験 4 化学変化と原子 分子



簡易電解装置 どの学校にもある ホフマンのh字管型電解 装置は 下端の電極のついたゴム栓が 水酸化ナトリウム溶液を使ったときにはずれやすく 思わぬ事故が起こることがあるが 電解装置としては やはりよくできている しかし 高価なので




3枚目の写真に拡大して載せてある解説の式ですが とはどこから出てきた数でし Clear




中学理科 水の電気分解のポイント




中学理科 ゴロ合わせ 水の電気分解 電極と気体の覚え方 Youtube



中2化学 水の電気分解 Hiromaru Note



ジュニア化学への招待 楽しい化学実験室 第4回 水の電気分解といろいろな電池 仙台市科学館 Sendai City Science Museum




中2 理科 中2 3 水に電流を流す Youtube




水の電気分解の解説 中学生向け



Www Chuo Tky Ed Jp Ginza Jh Resources Content 0515 Pdf



H管による水の電気分解 プラスマイナス 1 2 3 4 High Himazabu S Diary




水の電気分解 中学理科 By かたくり工務店 マナペディア



1 研究に取り組んだ観察 実験 4 化学変化と原子 分子 第1分野下 物質どうしは結びつくか 実験 水素と酸素の化合 2 観察 実験のねらい 大単元 化学変化と原子 分子 においては 生徒は分解や化合といった基本的な化学変化を目では見え




水の電気分解の解説 中学生向け



1



水の電気分解自分の持っている中学参考書 添付画像 では 陰極側に水素 Yahoo 知恵袋
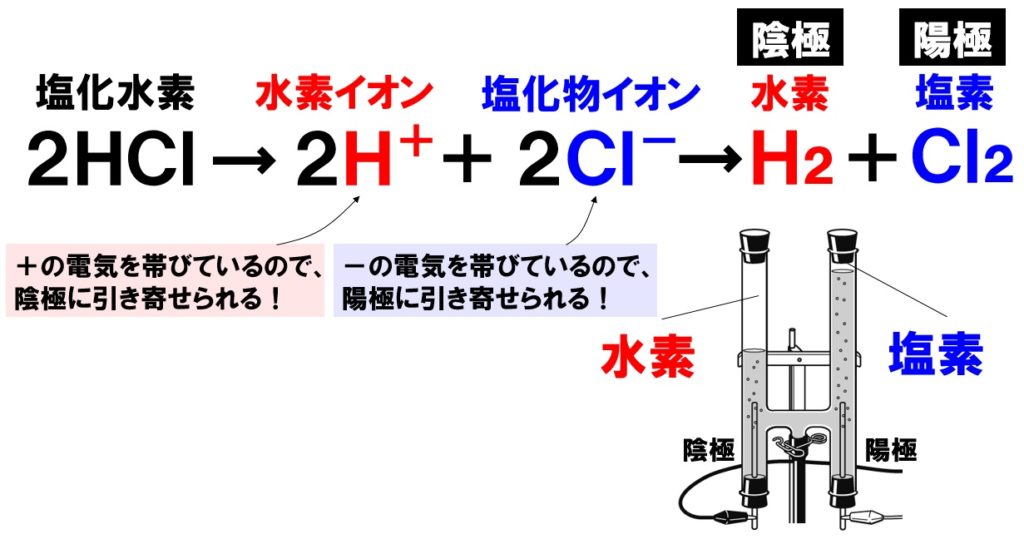



中3理科 塩酸の電気分解のポイント Examee



Www Jikkyo Co Jp Material Pdf Web Ni Link Pel Chemistry 9 9 Web Ni Link Pdf




君も化学者 簡単にできる水の電気分解 日本化学会 化学だいすきクラブ



水の電解




Title



水の電気分解の解説 中学生向け




中2化学 水の電気分解 Hiromaru Note




水の電気分解の解説 中学生向け



1 研究に取り組んだ観察 実験 4 化学変化と原子 分子 1分野下 実験2 水に電流を流して 出てくる物質を調べよう 2 観察 実験のねらい 水に電流を流したときの変化を観察し 生成した物質の性質を調べることを通して 水が水素と酸素の化合物




中2 理科 化学 第3回 水の電気分解 Youtube




化学講座 第29回 電気分解 ファラデーの法則 私立 国公立大学医学部に入ろう ドットコム




中学2 3年理科の化学計算 ゴロ合わせで化学を楽々制覇 その 原子量 水の電気分解 金属の酸化と燃焼 Studygeek スタディーギーク



塩酸の電解
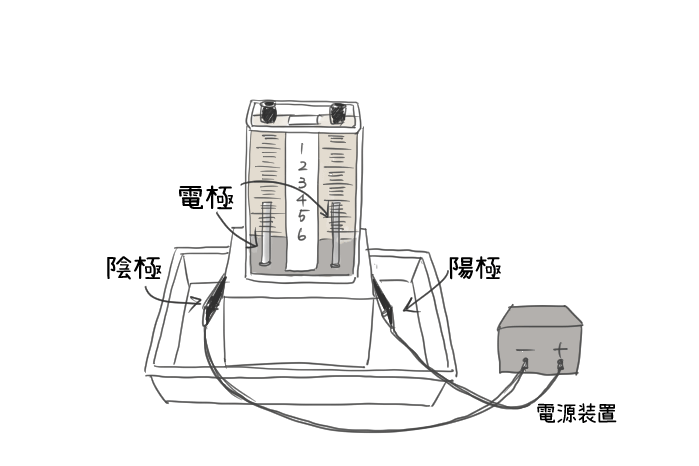



物質の分解 定期テスト対策問題 中学理科化学変化の確認練習問題まとめ 教科書をわかりやすく通訳するサイト




電気分解とは 電気分解を理解して定期テスト10点アップ 高校生向け受験応援メディア 受験のミカタ



1




水の電気分解をして2つの気体を調べよう 実験動画 理科の授業をふりかえる



0 件のコメント:
コメントを投稿